摩爾鹽,即硫酸亞鐵銨[(NH4)2Fe(SO4)2·6H2O],是一種淺綠色晶體,因其在分析化學中作為基準試劑的重要用途而聞名。它兼具亞鐵離子的還原性和良好的水溶性。以廢鐵屑、稀硫酸和硫酸銨為原料制備摩爾鹽,是一個典型的資源回收與綠色化學過程。
制備流程解析
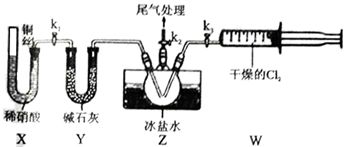
在所述的制備流程中,關鍵的第一步通常涉及對原料廢鐵屑的預處理。當問題中提到“步驟1中加Na2CO3溶液目的”時,其核心作用在于除油去銹。具體分析如下:
1. 除油污:廢鐵屑表面常附著有機油污。碳酸鈉(Na2CO3,俗稱純堿)溶液呈堿性,可以水解油脂,生成可溶性的高級脂肪酸鈉和甘油,從而有效去除油污。
2. 除鐵銹:鐵屑表面的鐵銹(主要成分為Fe2O3·xH2O)能與稀酸反應,但預先用堿液處理可以部分去除表面的氧化物,并使鐵屑表面更潔凈,有利于后續與稀硫酸反應時,純鐵能更充分、快速地接觸反應。
經過Na2CO3溶液煮沸清洗后,需用蒸餾水將鐵屑洗滌至中性,以避免引入雜質離子。
后續步驟簡要概括為:將潔凈的鐵屑與稀硫酸反應生成硫酸亞鐵溶液,過濾除去過量鐵屑,再向濾液中加入等物質的量的硫酸銨,經過蒸發濃縮、冷卻結晶、過濾、洗滌和干燥,即可得到摩爾鹽晶體。該工藝巧妙利用了硫酸亞鐵和硫酸銨溶解度的差異,使復鹽優先結晶析出。
與污水處理及再生利用的關聯
題目中提及的“污水處理及其再生利用”,與摩爾鹽的制備及性質有著深刻的聯系,體現了化學在環境保護中的應用:
- 原料的循環利用:制備流程以“廢鐵屑”為起點,本身就是對固體廢物的資源化利用,符合循環經濟原則,減少了資源浪費和處置壓力。
- 作為水處理劑:制得的摩爾鹽或其核心成分亞鐵離子(Fe2?),在污水處理領域有重要應用。
- 混凝/絮凝作用:在水處理中,硫酸亞鐵可作為無機混凝劑。Fe2?在水中水解生成具有吸附作用的Fe(OH)?絮體(進一步氧化可形成Fe(OH)?),能有效吸附、包裹水中懸浮的膠體顆粒和部分溶解性污染物,形成更大的礬花沉降,從而去除濁度、色度和部分有機物。
- 還原與沉淀作用:利用其還原性,可以處理含氧化性污染物的廢水,例如將毒性較強的六價鉻(Cr(VI))還原為毒性較低的三價鉻(Cr(III)),并在后續堿性條件下形成Cr(OH)?沉淀去除。
- 磷酸鹽去除:亞鐵離子能與廢水中的磷酸根形成沉淀,用于控制水體富營養化。
- 工藝流程的綠色化:制備摩爾鹽的化學反應(Fe + H2SO4 → FeSO4 + H2↑)副產物為氫氣,若能安全收集利用,可進一步增加過程的綠色價值。整個工藝條件溫和,使用的化學品相對常見且環境風險較低。
結論
在摩爾鹽制備的初始步驟中加入碳酸鈉溶液,是一項關鍵的預處理凈化操作,旨在去除廢鐵屑表面的油脂和雜質,保障后續反應的效率和產物的純度。而這一從廢物出發的制備過程,及其產物在水處理中的廣泛應用,完美詮釋了“變廢為寶”和“以廢治廢”的環保理念,是化學原理服務于資源再生與環境污染治理的生動例證。將實驗室制備與工業污水處理技術相聯系,有助于我們更全面地理解物質的性質與價值。